芯片资讯
- 发布日期:2024-01-13 07:42 点击次数:85
与注射给药相比,口服给药对专业技术的要求更低,并且患者的可接受度更高,一直是首选的给药方式。然而,多肽、蛋白质和核酸等生物药物极易在胃肠道恶劣的生化环境中失活,并且很难通过胃肠道黏膜层细胞的吸收屏障,直接口服的生物利用度极为有限(小于1%),导致这些生物药物目前仍然主要通过肠外注射进行递送。而肠外注射,尤其是像胰岛素这种需要长期进行注射的药物,难免会引起疼痛和皮肤感染。因此,亟需克服生物药物口服递送的困境,提高口服药物的生物利用度。
虽然目前已经有研究开发出了黏附贴片、水凝胶滞留等延长药物释放时间的缓释装置,但是并没有真正克服消化道的生理屏障,临床效果仍需验证。而胃肠道微针装置直接利用载药微针刺入缺少痛觉神经的胃肠壁进行给药,既可以直接突破胃肠道的吸收屏障,同时也不会引起患者的疼痛和不适,是一种新兴的口服给药方式。然而,之前研究中提出的弹簧或气球驱动的一次性触发模式难以保证微针穿透的可靠性,磁场等外场调控的方式仍然需要额外的设备。同时,使用金属弹簧、不可降解塑料或磁性颗粒等制作口服机器人势必会引起患者的担忧。因此,开发一种新型口服给药装置解决上述问题具有重要意义。
近期,清华大学医学院张明君教授和机械系徐静副教授团队受到刺豚膨胀启发,联合开发了一种利用肠蠕动来驱动微针刺入肠壁的无痛可降解给药机器人。在小型巴马猪上进行的动物实验表明,该微针机器人递送胰岛素的生物利用度达到23.6%,并且能够顺利通过小型猪的消化道,没有引起肠梗阻。肠道组织学分析显示微针刺入部分肠壁迅速恢复,炎症反应有限。相关工作以“Pain-free oral delivery of biologic drugs using intestinal peristalsis–actuated microneedle robots”为题发表在ScienceAdvances期刊上。 在这项研究中,研究人员设计了一个三层结构的微针机器人。最内层为高粘度羧甲基纤维素钠(SCMC)合成的超吸水性水凝胶颗粒,中间是聚乙烯醇(PVA)和丙烯酰胺(AAm)混合交联形成的可拉伸薄膜。该薄膜一方面包裹内部的水凝胶颗粒,另一方面作为承载最外侧载药微针的基底。载药微针是由聚乙二醇二丙烯酸酯(PEGDA)和聚乙二醇(PEG)混合交联制成的双层倒刺结构, 电子元器件采购网 上层倒刺中载有生物药物。该微针机器人可以被装入00号医用肠溶胶囊中,口服之后可以顺利通过胃中的强酸性环境。到达小肠后,肠溶胶囊融化,微针机器人开始吸水膨胀,同时在肠道蠕动的挤压下将微针刺入肠壁。肠道舒张时,微针载药的倒刺断裂留在肠壁中,药物持续溶出并且微针逐渐降解,而微针机器人的主体则随着肠道蠕动不断被挤压破裂,并逐渐被排出体外(图1)。
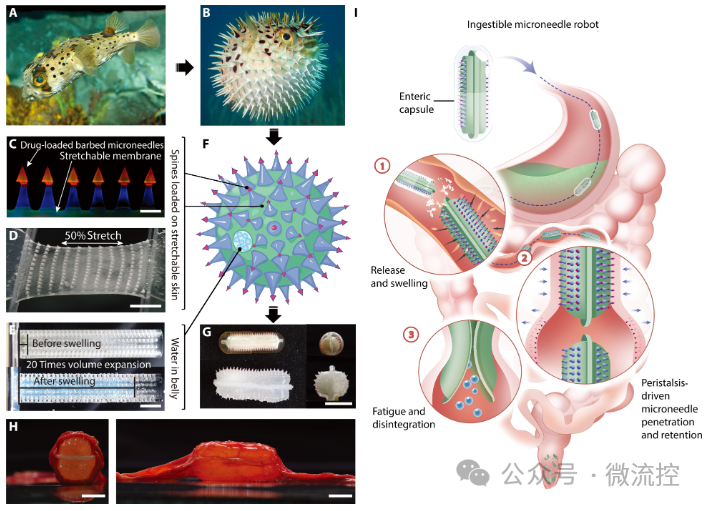 图1肠蠕动驱动的刺豚启发的用于口服递送生物药物的微针机器人
图1肠蠕动驱动的刺豚启发的用于口服递送生物药物的微针机器人
为了设计机器人的尺寸以保证微针在受到小肠挤压时能够刺入肠壁,研究人员在巴马迷你猪上进行了肠道测压和微针穿透评估。通过胶囊形测压传感器测量了不同尺寸机器人受到的肠蠕动压力,并且通过与微针刺入小肠组织所需的力进行对比确定微针机器人的最小尺寸。再通过对微针机器人膨胀过程进行力学分析,设计微针机器人膨胀前的尺寸、可拉伸膜的弹性模量和水凝胶颗粒的填充率。使其既能放入肠溶胶囊,又能在膨胀后达到足够的尺寸以产生足够的蠕动压力,同时保持足够的硬度以支撑载药微针刺入肠壁(图2)。并且,研究人员将载药微针设计成双层倒刺结构,可以保证肠道舒张时载药层可以断裂在肠壁中,实现持续给药(图3)。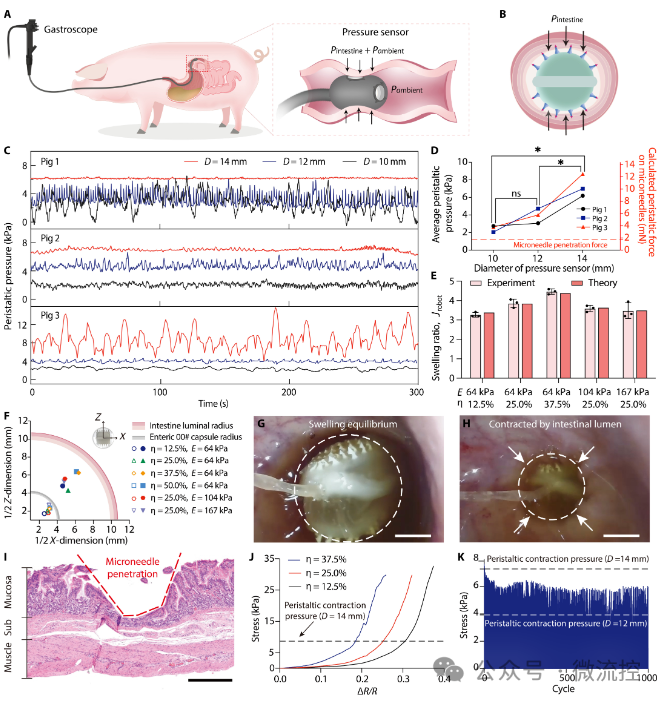 图2 肠道测压及微针穿刺实验
图2 肠道测压及微针穿刺实验
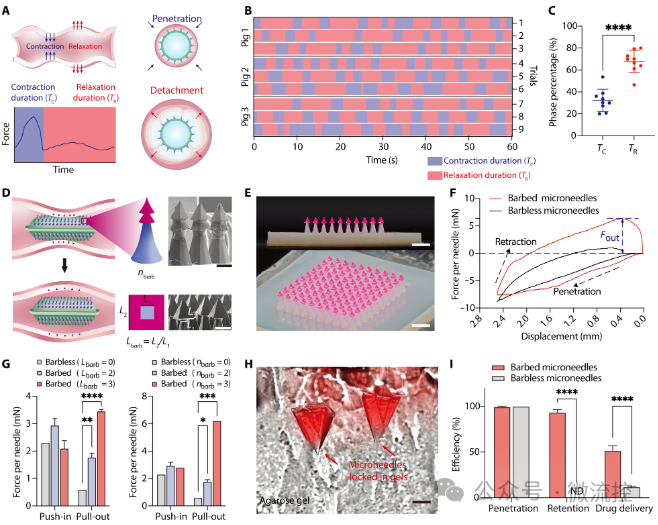 图3 倒刺微针设计及实验
图3 倒刺微针设计及实验
最后,在巴马小型猪上进行的实验表明,使用本研究提出的倒刺微针机器人递送胰岛素可以实现23.6%的生物利用度,是直接口服胰岛素的37.7倍。同时,与无倒刺微针机器人的递送效果的对比也说明了倒刺结构的贡献。并且,连续一周的X光拍摄显示,递送到小型猪食道的五个含有硫酸钡的胶囊都顺利通过了猪的消化道,并没有导致猪出现肠梗阻和饮食习惯改变等明显异常。以上实验验证了微针机器人作为生物药物口服给药平台的有效性和安全性(图4)。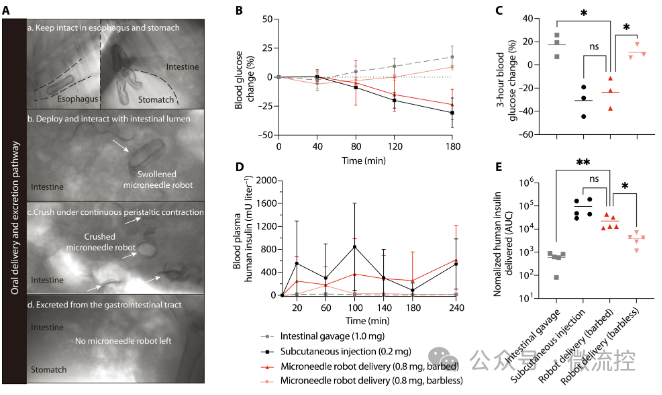 图4 微针机器人的有效性和安全性验证
图4 微针机器人的有效性和安全性验证
综上所述,本研究所提出的肠蠕动驱动的微针机器人为生物药物的口服递送提供了一个有前景的平台,有可能在多个领域提高治疗的舒适度。不过,由于不同人的肠蠕动频率和强度有较大差异,未来的临床研究可能需要考虑如何使其在更大的个体差异范围内发挥作用。
清华大学医学院张明君教授和机械系徐静副教授为该论文的共同通讯作者,医学院博士研究生高喜泽和机械系博士研究生李家聪为共同第一作者。本研究受到国家自然科学基金等项目的资助。
论文链接:
https://www.science.org/doi/10.1126/sciadv.adj7067
审核编辑:刘清
- 电动车发动机再制造和再利用技术的研究2024-01-05







